مهندسی شیمی
دانلود جزوه -کتاب-مقالهمهندسی شیمی
دانلود جزوه -کتاب-مقالهاندازه گیری اکسیژن آب DO
نگاه اجمالی
آب طبیعی معمولاً حاوی مقداری گاز اکسیژن میباشد. اکسیژن در گوارا کردن آب و خوش طعم نمودن آن اهمیت زیادی دارد. زندگی حیوانات و گیاهان آبزی به حداقل غلظت اکسیژن محلول در آب بستگی دارد. ماهی ، بیش از سایر جانداران و باکتری کمتر از تمام آبزیان به اکسیژن محلول نیاز دارد. مقدار اکسیژن محلول در آبی که ماهی در آن پرورش مییابد، نباید کمتر از 5PPM باشد. در صورتیکه مقدار اکسیژن موجود در آب کمتر از حداقل مجاز برای زندگی جانداران آبزی باشد، آن آب آلوده تلقی میشود. آبهای سطحی (اکسیژن محلول در آب) بیشتری از آبهای زیرزمینی دارند.
(اکسیژن محلول در آب) بیشتری از آبهای زیرزمینی دارند. عوامل موثر در مقدار 
مقدار اکسیژن محلول در آب ، طبق قانون هنری ، تابعی از دما و فشار جزئی اکسیژن موجود در محیط است، همچنین به مواد موجود در آب هم بستگی دارد. غلظت اکسیژن حل شده در آب کم است بنابراین از لحاظ بومشناختی ناپایدار است. مقدار اکسیژن در صفر درجه و فشار متعارفی حدود 14,6ppm می باشد. این مقدار در 20 درجه سانتیگراد به 9,2ppm میباشد.
انحلال پذیری گازها با افزایش دما کاهش مییابد. بنابراین آب رودخانهای که بطور مصنوعی گرم شده است، دچار آلودگی گرمایی میباشد و
 آن کمتر از آبهای سرد است. آلودگی گرمایی آب ، اغلب به علت نیروگاههای برق میباشد که آب سرد را از رودخانهها یا دریاچه برای خنک کردن دستگاهها بکار میبرند و آب گرمشده را به منبع اصلی برمیگردانند.
آن کمتر از آبهای سرد است. آلودگی گرمایی آب ، اغلب به علت نیروگاههای برق میباشد که آب سرد را از رودخانهها یا دریاچه برای خنک کردن دستگاهها بکار میبرند و آب گرمشده را به منبع اصلی برمیگردانند. نقش مواد آلی در کاهش 
وجود مواد شیمیایی احیا کننده و بویژه مواد آلی در آب موجب مصرف و کاهش مقدار اکسیژن محلول میگردد. فاضلابها و پسابهای صنعتی و خانگی ، حاوی مقادیر زیادی مواد آلی هستند. تخلیه آنها در آبها ، بسرعت باعث آلودگی آب و کاهش  میشود. آبهای جاری در نهرها و رودخانههای کمعمق که هوادهی میشود، بطور
مداوم اکسیژندار میشوند. اما آبهای راکد یا آبی که نزدیک کف یک دریاچه
عمیق است، تقریباً عاری از اکسیژن است، زیرا با ماده آلی واکنش دارد و هیچ مکانیسمی برای تجدید آن وجود ندارد.
میشود. آبهای جاری در نهرها و رودخانههای کمعمق که هوادهی میشود، بطور
مداوم اکسیژندار میشوند. اما آبهای راکد یا آبی که نزدیک کف یک دریاچه
عمیق است، تقریباً عاری از اکسیژن است، زیرا با ماده آلی واکنش دارد و هیچ مکانیسمی برای تجدید آن وجود ندارد.از شاخصهای اساسی کیفیت آبها و پسابها تعیین مقادیر BOD (مقدار اکسیژن لازم جهت تجزیه مواد آلی موجود در آب) و COD ( اکسیژن لازم برای اکسیداسیون مواد قابل اکسید شدن موجود در آب) میباشد. تعیین
 یک روش کلیدی برای تعیین شاخص های مذکور به شمار میرود.
یک روش کلیدی برای تعیین شاخص های مذکور به شمار میرود. نقش اکسیژن محلول در خاصیت خورندگی آب
اکسیژن محلول در آب یکی از دلایل اصلی خاصیت خورندگی آب می باشد، آهن و اکسیژن در تماس با آب ، تشکیل قطبهای کاتد و آند را میدهند. آهن به عنوان آند عمل کرده ، به هیدروکسید فرو و سپس به هیدروکسید فریک و بعد از آن به اکسید آهن تبدیل میشود. با توجه به مشکلات متعددی که وجود اکسیژن در آبهای صنعتی (بویژه در آب جوشاورها) ایجاد میکند، حذف آن از آبهایی که استفاده صنعتی دارند، لازم است.روشهای حذف اکسیژن محلول از آب
حذف از آب را معمولاً تجزیه هوازدایی مینامند که به روش فیزیکی و شیمیایی انجام میگیرد. در روش فیزیکی از دستگاه خاصی استفاده میشود که با استفاده از جریان متضاد آب و بخار داغ ، اکسیژن را از آب خارج میکند. پس از هوازدایی به روش فیزیکی برای تکمیل عملیات از روش شیمیایی استفاده میشود که به سه صورت انجام میگیرد:
از آب را معمولاً تجزیه هوازدایی مینامند که به روش فیزیکی و شیمیایی انجام میگیرد. در روش فیزیکی از دستگاه خاصی استفاده میشود که با استفاده از جریان متضاد آب و بخار داغ ، اکسیژن را از آب خارج میکند. پس از هوازدایی به روش فیزیکی برای تکمیل عملیات از روش شیمیایی استفاده میشود که به سه صورت انجام میگیرد:- اضافه کردن سولفیت سدیم (با جذب اکسیژن به سولفات سدیم تبدیل میگردد)
- اضافه کردن هیدرازین
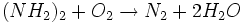
- استفاده از گاز
 در محیط قلیایی
در محیط قلیایی

روشهای اندازه گیری 
روش فیزیکی
امروزه برای اندازه گیری در محل نمونه برداری از دستگاههای کوچک سیار که مجهز به الکترود غشایی است، استفاده میشود. الکترود غشایی بر اساس سرعت نفوذ مولکولهای اکسیژن از یک غشا ساخته شده است. این روش فیزیکی بطور ساده و سریع انجام میگیرد.
در محل نمونه برداری از دستگاههای کوچک سیار که مجهز به الکترود غشایی است، استفاده میشود. الکترود غشایی بر اساس سرعت نفوذ مولکولهای اکسیژن از یک غشا ساخته شده است. این روش فیزیکی بطور ساده و سریع انجام میگیرد. روش شیمیایی وینکلر یا یدومتری
یدومتری دقیقترین و قابل اعتمادترین روش اندازه گیری  میباشد. این روش یک روش تیتراسیونی است که بر اساس خواص اکسیدکنندگی اکسیژن محلول انجام میگیرد. با افزایش
میباشد. این روش یک روش تیتراسیونی است که بر اساس خواص اکسیدکنندگی اکسیژن محلول انجام میگیرد. با افزایش  به محلول قلیایی شده آب ، هیدروکسید منگنز با اکسیژن محلول آب ترکیب شده ، ایجاد
به محلول قلیایی شده آب ، هیدروکسید منگنز با اکسیژن محلول آب ترکیب شده ، ایجاد  میکند. با مصرف تمام اکسیژن موجود ، محلول اسیدی میشود. با افزودن یدور ،
میکند. با مصرف تمام اکسیژن موجود ، محلول اسیدی میشود. با افزودن یدور ،  در محیط اسیدی با یون یدور ، وارد واکنش شده ، ید آزاد میکند. مقدار ید آزاد شده توسط محلول تیوسولفات تعیین میشود و از روی مقدار تیوسولفات مصرفی ، مقدار اکسیژن موجود در آب محاسبه میشود.
در محیط اسیدی با یون یدور ، وارد واکنش شده ، ید آزاد میکند. مقدار ید آزاد شده توسط محلول تیوسولفات تعیین میشود و از روی مقدار تیوسولفات مصرفی ، مقدار اکسیژن موجود در آب محاسبه میشود.
اساس روش اندازهگیری:
معمولیترین
روش تعیین اکسیژن محلول بر اساس آزاد کردن ید توسط اکسیژن محلول میباشد.
ید آزاد شده عموماً توسط یک محلول احیاءکننده مانند تیوسولفات سدیم
اندازهگیری میشود. چسب نشاسته خاتمه عمل را نشان میدهد. نشاسته ید آزاد
شده را جذب نموده و رنگ آبی ایجاد میکند و هنگامیکه تمامی ید احیاء گردید
محلول بیرنگ میشود.
روش و نیکلر یا یدومتری روش استانداردی برای تعیین
اکسیژن محلول میباشد. این روش بر اساس اکسیداسیون Mn2+ به ظرفیت بالاتر
(Mn4+) در محیط قلیائی توسط اکسیژن میباشد. منگنز با ظرفیت چهار یون ید را
در محیط اسیدی به ید آزاد اکسیده میکند و مقدار ید آزاد شده که برابر با
اکسیژن محلول میباشد توسط تیتزاسیون با تیوسولفات استاندارد اندازهگیری
میشود.
در این روش وجود بعضی از مواد مانند نیتویتها و آهن سه ظرفیتی
قابلیت اکسیدکنندگی I- را به I2 دارند. و نتیجه آزمایش را زیاد نشان
میدهد. و بر عکس مواد احیاء کننده مانند S2-, So32-, Fe2+ ید را احیاء
کرده و به I- تبدیل میکنند و نتیجه آزمایش را کمتر از حد واقعی نشان
میدهد. بنابراین روش تصحیح نشده چنانکه اکسیژن در محیط وجود نداشته باشد
با افزایش سولفات منگنز و معرف یدور قلیائی (NaOH, KI) رسوب سفید رنگ
2Mn(OH) تشکیل میگردد.
Mn2+ + 2OH- Mn(OH)2

روش شیمیایی وینکلر یا یدومتری :
یدومتری دقیقترین و قابل اعتمادترین روش اندازه گیری میباشد. این روش یک روش تیتراسیونی است که بر اساس خواص اکسیدکنندگی اکسیژن محلول انجام میگیرد.
با افزایش به محلول قلیایی شده آب ، هیدروکسید منگنز با اکسیژن محلول آب ترکیب شده ، ایجاد میکند. با مصرف تمام اکسیژن موجود ، محلول اسیدی میشود. با افزودن یدور ، در محیط اسیدی با یون یدور ، وارد واکنش شده ، ید آزاد میکند.
مقدار ید آزاد شده توسط محلول تیوسولفات تعیین میشود و از روی مقدار تیوسولفات مصرفی ، مقدار اکسیژن موجود در آب محاسبه میشود.
این روش یک روش تیتراسیونی است که بر اساس خواص اکسیدکنندگی اکسیژن محلول
انجام میگیرد. با افزایش به محلول قلیایی شده آب ، هیدروکسید منگنز با
اکسیژن محلول آب ترکیب شده ، ایجاد میکند. با مصرف تمام اکسیژن موجود ،
محلول اسیدی میشود. با افزودن یدید ، در محیط اسیدی با یون یدید ، وارد
واکنش شده ، ید آزاد میکند. مقدار ید آزاد شده توسط محلول تیوسولفات تعیین
میشود و از روی مقدار تیوسولفات مصرفی (با استفاده از شناساگر نشاسته) ،
مقدار اکسیژن موجود در آب محاسبه میشود.
یون یدید یک عامل کاهنده ی نسبتاً موثری است که به طور وسیعی برای تجزیه ی اکسنده ها به کار می
رود.
به طور کلی به واکنش هایی که در آن ید اکسید می گردد، یعنی ید از محلول یدیدها آزاد می گردد یدومتری
گویند. روشهای زیادی بر اساس خواص کاهندگی یون یدید استوارند. ید که محصول واکنش است، معمولاً
با محلول استاندارد تیوسولفات تیتر می شود.


























