مهندسی شیمی
دانلود جزوه -کتاب-مقالهمهندسی شیمی
دانلود جزوه -کتاب-مقالهاندازه گیری قلیائیت آب
اندازه گیری قلیائیت آب
قلیائیت به صورت P Alk یا M Alk (یا T Alk) نشان داده می شود و برحسب ppm CaCO3 گزارش می شود.
منشاء قلیائیت در آب وجود یون های هیدروکسید (-OH) ، کربنات (2-CO3) و بی کربنات (-HCO3) می باشد. البته براتها (3-BO3) ، فسفات ها (3-PO4) و سیلیکات ها (3-SiO3) نیز می توانند ایجاد قلیائیت کنند.
قلیائیت آب ، ظرفیت کمی آب در خنثی نمودن یک اسید قوی تا PH مورد نظر می باشد. تعیین قلیائیت در تفسیر و کنترل فرآیندهای تصفیه آب و فاضلابها کاربرد فراوانی دارد.
قلیائیت می تواند به پنج صورت زیر وجود داشته باشد:
- محلول فقط شامل هیدروکسید (-OH) باشد.
- محلول فقط شامل کربنات (2-CO3) باشد.
- محلول فقط شامل بی کربنات(-HCO3) باشد.
- محلول شامل کربنات و بی کربنات (2-CO3) و (-HCO3) باشد.
- محلول شامل هیدروکسید و کربنات (-OH) و (2-CO3) باشد.
در صورتی آب دارای قلیائیت است که PH آن از 4.6-4.3 بالاتر باشد.
قلیائیت شامل قلیائیت فنل فتالئین (P) و متیل اورانژ یا قلیائیت کل (T یا M) می باشد.
قلیائیت فنل فتالئین مربوط به نمکهائی است که PH آنها از 8.2 (PH تغییر رنگ فنل فتالئین) بالاتر باشد یعنی نمکهایی است که دارای عامل هیدروکسید(-OH) و کربنات (2-CO3) هستند.
قلیائیت متیل اورانژ شامل قلیائی هایی است که PH آنها از 4.5 (PH تغییر رنگ متیل اورانژ) بالاتر باشد یعنی قلیائی هایی که شامل هیدروکسید (-OH) ، کربنات (2-CO3) و بی کربنات (-HCO3) هستند.
برای اندازه گیری قلیائیت از یک اسید قوی مانند اسید سولفوریک یا اسید کلریدریک 0.02 نرمال استفاده می کنند.
روش تعیین قلیائیت
به حجم مشخصی از نمونه چند قطره معرف فنل فتالئین اضافه می کنند (حجم بستگی به قلیائیت نمونه دارد) اگر قلیائیت بالا باشد حجم کمتری انتخاب می کنیم اگر محلول تغییر رنگ نداد محلول قلیائیت فنل فتالئین ندارد (PH=0) و حاوی یونهای هیدروکسید و کربنات نیست اگر بعد از اضافه کردن فنل فتالئین رنگ محلول ارغوانی شد محلول دارای قلیائیت فنل فتالئین است. سپس محلول را با اسید کلریدریک 0.02 نرمال تیتر می کنند تا محلول بی رنگ شود. حجم اسید کلریدریک مصرفی را یادداشت می کنند. (A cc)
برای تعیین قلیائیت متیل اورانژ چند قطره معرف متیل اورانژ اضافه کرده و در صورتیکه رنگ محلول قرمز مایل به پوست پیازی شد نشان دهنده P=M است. اگر رنگ محلول زرد شد عمل تیتراسیون با اسید کلریدریک 0.02 نرمال را ادامه داده تا رنگ محلول به نارنجی یا پوست پیازی تغییر رنگ دهد. حجم اسید مصرفی را یادداشت می کنند. (B cc)
چنانچه تشخیص نقطه پایان تیتراسیون در قلیائیت متیل اورانژ مشکل باشد از PH متر یا معرف مخلوط استفاده می کنند. معرف مخلوط (Indicator Mix) مخلوط دو معرف متیل رد و برموکروزول می باشد و تغییر رنگ از سبز به صورتی می باشد.
مراحل ختم عمل در Indicator Mix:
| آبی – سبز |
PH > 5.2 |
| سبز | PH = 5 |
| صورتی – خاکستری | PH = 4.8 |
| صورتی | PH = 4.6 |
نقطه پایان تیتراسیون در PH = 4.6 و تغییر رنگ از سبز به صورتی می باشد.
ادامه مطلب ...
اندازه گیری اسیدیته آب
عوامل ایجاد کننده اسیدیته در آب:
اسید سولفوریک (H2SO4) و اسید نیتریک (HNO3) و اسید کلریدریک (HCl) عوامل ایجاد کننده اسیدیته در آب می باشند. برای اندازه گیری اسیدیته (FMA) باید غلظت یون های Cl- ، SO42- و NO3– را اندازه گیری نمود و غلظت یون های سولفات و نیترات و کلرور بر حسب ppm کربنات کلسیم محاسبه و مجموع آنها FMA می باشد.
1- تبدیل غلظت SO4-2 از ppm SO4 به ppm کربنات کلسیم:
SO42- ≡ CaCO3
[SO4 2-] (as ppm SO4) × 1.04 = ppm CaCO3
2- تبدیل غلظت -Cl از ppm Cl به ppm کربنات کلسیم:
[Cl -] (as ppm Cl) × 1.41 = ppm CaCO3
3- تبدیل غلظت -NO3از NO3 ppm به ppm کربنات کلسیم:
[NO3-] (as ppm NO3) × 0.64 = ppm CaCO3
خلاصه:
[NO3-] (as ppm NO3) × 0.64 = ppm CaCO3
[Cl -] (as ppm Cl) × 1.41 = ppm CaCO3
[SO4 2-] (as ppm SO4) × 1.04 = ppm CaCO3
FMA برحسب ppm کربنات کلسیم برابر است با :
FMA(as ppm CaCO3)= SO42- (ppmCaCO3) +Cl-(ppmCaCO3 )+ NO3-( ppmCaCO3)
مثال :
در یک نمونه آب غلظت سولفات 4ppm و نیترات 2ppm و کلرو6ppm است . اسیدیته (FMA) را محاسبه کنید.
4 (ppm SO42-)× 1.04=4.16 ppmCaCO3
2 (ppm NO3-)× 0.81=1.62ppmCaCO3
6 (ppm Cl-)× 1.41=8.46 ppmCaCO3
FMA=4.16+1.62+8.46=14.24 ppmCaCO3
FMA=14.24 ppmCaCO3
FMA زمانی وجود دارد که PH از 4.3 کمتر باشد . بنا براین ابتدا PH نمونه را اندازه گیری نموده و اگر PH از 4.3 بالاتر باشد اسیدیته آزاد ( FMA ) صفر خواهد بود . برای اندازه گیری اسیدیته آب میتوان از رزین زئولیت هیدروژن استفاده کرد . برای این کار نمونه آب را از زئولیت هیدروژن عبور می دهند.
H2Z + Ca2+ → CaZ + 2 H+
H2Z + Mg2+ → MgZ + 2 H+
H2Z + 2K+ → K2Z + 2 H+
H2Z + 2Na+ → Na2Z + 2 H+
با شروع بهره برداری از زئولیت هیدروژن ، FMA خیلی بالا است . به مرور FMA به مقدار خیلی کم کاهش می یابد . وقتی که رزین اشباع می شود ، FMA یک نزول ناگهانی دارد که در اینجا رزین اشباع شده و باید آن را احیا کرد.
روش FMA بطریق عملی :
به مقدار مشخصی نمونه ، معرف متیل اورانژاضافه کرده و با محلول کربنات سدیم 02/0 نرمال تیتر میکنند تا رنگ محلول از صورتی به زرد تغییر کند .
ppm اسیدیته آزاد (FMA) برحسب کربنات کلسیم برابر است با :
ppm FAM (as CaCO3)= V(ml) Na2CO3 × 0.02 N × 1000/V Sample(ml)
اگر 50 میلی لیتر نمونه استفاده شود:
Ppm FMA (as CaCO3 ) =V(ml) Na2CO3 0.02 N × 20
Na2CO3 + 2H+ → H2O + CO2 + 2Na+
2H+ ≡ Na2CO3 ≡ CaCO3
|
100×1000 mg |
2×1000×1 |
|
X |
(V×N) Na2CO3 |
X=A mg
|
V ml |
A mg |
|
1000 |
X |
اگر نرمالیته کربنات سدیم 0.02 نرمال و حجم نمونه مصرفی 50 میلی متر باشد در نتیجه:
FMA = V(ml) Na2CO3 × 20 ppm CaCo3
معایب روش اندازه گیری FMA :
1- اگر نمونه رنگی باشد نمی توان از معرف متیل اورانژ استفاده کرد زیرا رنگ محلول را می پوشاند ، برای تشخیص ختم عمل باید از PH متر استفاده کرد.
2- کلر آزاد (Cl2) رنگ معرف را از بین می برد که برای حذف کلر آزاد از تیوسولفات سدیم استفاده می کنند. یک قطره برای رفع مزاحمت کلر آزاد کافی است.
Cl2 + 2 e- → 2Cl-
2S2O32- →S4O62- + 2e-
Cl2 + 2Na2S2O3 → 2Nacl + Na2S4O6
Cl2 ≡ 2 S2O32-
Cl2 ≡ 2 Na2S2O3
به ازای یک ppm کلر آزاد دو ppm تیوسولفات سدیم نیاز است.
ادامه مطلب ...
تعیین سختی موقت و دائمی آب
عنوان : اندازه گیری سختی آب (1)
هدف آزمایش : اندازه گیری یون های کلسیم و منیزیم موجود در آب های قابل شرب شهری – آشنایی با انواع سختی آب
مقدمه و تئوری:
سختی آب : ناشی از املاح کلسیم و منیزیم و به میزان کمتر ناشی از املاح آلومینیم ، روی ، منگنز، آهن و .. است.
اهمیت سختی آب
مقدار سختی آب ، علاوه بر اینکه در آبهای صنعتی اهمیت وافر دارد، از نظر بهداشت عمومی نیز اهمیت خاصی دارد. کلسیم که یکی از عوامل سختی آب است، در رشد استخوان و حفظ تعادل بدن دخالت داشته، ولی به همان اندازه ، سولفات کلسیم به علت کمی قابلیت هضم ، ناراحتی هایی در دستگاه هاضمه بوجود میآورد.
گاهی توصیه میشود که جهت تامین بهداشت و سلامت مصرف کنندگان ، آهک به آب آشامیدنی افزوده شود. بعضی دانشمندان معتقدند، بهتر است کلسیم و منیزیم لازم بدن توسط غذا تامین شود و حتیالامکان از آبهای سبک برای شرب استفاده شود. باید توجه داشت که بدن نسبت به سنگینی موجود در آب مورد مصرف خود حساسیت دارد، چنانچه این نوشیدنی تغییر یابد، ممکن است در دستگاه گوارش ایجاد اخلال نماید و این موضوع را به اصطلاح آب به آب شدن میگویند.
زیانهای سختی آب:
1- ایجاد سوء هاضمه.
2- کدر کردن آب جوش.
3- گوارایی آب را کم میکند.
4- دیر شدن پخت و پز به ویژه در مورد حبوبات و سبزیجات.
5- سختی آب در واکنش با صابون، رسوبهایی ایجاد میکند که در منافذ پوست باقی می مانند و باعث زبری پوست میشوند
6- ایجاد رسوب و اتلاف انرژی در لوله و دستگاههایی که آب گرم دارند.
7- مصرف پاک کننده بیشتر برای شستشو.
سختی موقت : سختی موقت (Temporary Hardner) را سختی کربناتی (Carbonate Hardner) نیز مینامند. این سختی ، مولود بیکربنات کلسیم و منیزیم است که عمدتا به کمک حرارت و یا استفاده از کربنات کلسیم از بین میرود.
در اینجا بی کربنات ها به شکل کربنات رسوب کرده و سختی از بین می رود.
سختی دائم : سختی دائم (Permanent Hardner) را سختی غیرکربناتی (Noncarbonate Hardner) نیز مینامند. این سختی ، با حرارت دادن قابل حذف نیست.
مولود کلرید، سولفات ، نیترات، هیدروکسید، منیزیم ، و کلسیم است. برای از بین بردن سختی دائم از نرم کننده های یونی ( تبادل کننده های یونی ) مثل فسفات سدیم استفاده می شود.
سختی آب را بر حسب ppm کربنات کلسیم ( میلی گرم کربنات کلسیم در 1 لیتر آب ) گزارش می دهند.
وسایل :
بورت 25 ml – بشر 150 ml – بشر 250 ml – ارلن مایر 250 ml – پیپت حجم سنجی
مواد :
محلول کلریدریک اسید 0.1 M استاندارد – شناساگر متیل اورانژ – یک نمونه از آب سخت
روش کار :
1- ارلن را شسته و 25 میلی لیتر آب شهر ( آب سخت؛ تیتر شونده ) را در ارلن میریزیم.
2- دو قطره متیل اورانژ ( شناساگر ) را به آن اضافه میکنیم. ( متیل اورنژ برای تشخیص نقطه ی پایانی مورد استفاده قرار میگیرد. ) مشاهده می شود که محلول به رنگ زرد در خواهد آمد.
3- بورت را با کمی HCl شستشو داده و سپس بورت را با حجمی دلخواه ، از HCl با غلظت 0.1 M پر می کنیم.
4- HCl ( تیترانت ) را با بورت قطره قطره به محلول ارلن اضافه میکنیم. مشاهده می گرد که محلول به رنگ نارنجی در خواهد آمد.
متیل اورانژ در محلول بازی به رنگ زرد و در محلول اسیدی نارنجی می شود.
نتیجه : طبق جدول زیر به دست آوردن عدد 800 برای سختی آب غیر طبیعی است. در این آزمایش به علت عدم شستشوی کامل بورت و در نتیجه وجود مقداری از محلولی دیگر در آن باعث اشتباه در اندازه گیری ها شد.
|
آب سخت |
200-500 ppm |
|
سختی متوسط |
100-200 ppm |
|
سختی کم |
55-100 ppm |
|
آب نرم |
<50 ppm |
تهیه آب برای صنعت از روشهای نوین
گستردگی صنعت و پیشرفت فناوری باعث گردیده تهیه آب برای صنعت نیز دارای تنوع و دگرگونیهای زیادی گردد. امروزه صنایع بدلیل استفاده از دستگاههای بسیار خاص و گران قیمت نیازمند آبی با تصفیه ای بخصوص می باشند که در این راستا بایستی از روشهایی ویژه بجز سبکهای قدیمی، ترسیب و تغویض یونی با استفاده از رزینها بکار گرفته شود.
مهمترین و کارآمدترین این روشها، استفاده از غشاءهای بسیار نازک با سوراخهایی با قطر کمتر از یک میکرومتر می باشد. این غشاءها عمدتا از جنس استات سلولز بوده و قادر است از عبور املاح محلول جلوگیری کرده و بدینوسیله آب را با راندمان قابل توجهی تصفیه کند.
یکی از مشهورترین این روشها اسمز معکوس (Revers Osmosis) می باشد که از غشاءهایی با قابلیت عبور مولکولهای آب و حذف دیگر املاح آب تا نزدیک به 90% استفاده می نماید.
یکی دیگر از این روشها الکترودیالیز معکوس [(Electro Dialysis Reversal) EDR] می باشد. در روش EDR از غشاهایی با خاصیت انتخابی استفاده می گردد.
لازم به ذکر است اگرچه قیمت پایه این دستگاهها برای کشورهای در حال توسعه زیاد می باشد اما استفاده از آنها با هزینه راهبری کمتری نسبت به روشهای تعویض یونی (Ion Exc) همراه خواهد بود.
اندازه گیری اکسیژن آب DO
نگاه اجمالی
آب طبیعی معمولاً حاوی مقداری گاز اکسیژن میباشد. اکسیژن در گوارا کردن آب و خوش طعم نمودن آن اهمیت زیادی دارد. زندگی حیوانات و گیاهان آبزی به حداقل غلظت اکسیژن محلول در آب بستگی دارد. ماهی ، بیش از سایر جانداران و باکتری کمتر از تمام آبزیان به اکسیژن محلول نیاز دارد. مقدار اکسیژن محلول در آبی که ماهی در آن پرورش مییابد، نباید کمتر از 5PPM باشد. در صورتیکه مقدار اکسیژن موجود در آب کمتر از حداقل مجاز برای زندگی جانداران آبزی باشد، آن آب آلوده تلقی میشود. آبهای سطحی (اکسیژن محلول در آب) بیشتری از آبهای زیرزمینی دارند.
(اکسیژن محلول در آب) بیشتری از آبهای زیرزمینی دارند. عوامل موثر در مقدار 
مقدار اکسیژن محلول در آب ، طبق قانون هنری ، تابعی از دما و فشار جزئی اکسیژن موجود در محیط است، همچنین به مواد موجود در آب هم بستگی دارد. غلظت اکسیژن حل شده در آب کم است بنابراین از لحاظ بومشناختی ناپایدار است. مقدار اکسیژن در صفر درجه و فشار متعارفی حدود 14,6ppm می باشد. این مقدار در 20 درجه سانتیگراد به 9,2ppm میباشد.
انحلال پذیری گازها با افزایش دما کاهش مییابد. بنابراین آب رودخانهای که بطور مصنوعی گرم شده است، دچار آلودگی گرمایی میباشد و
 آن کمتر از آبهای سرد است. آلودگی گرمایی آب ، اغلب به علت نیروگاههای برق میباشد که آب سرد را از رودخانهها یا دریاچه برای خنک کردن دستگاهها بکار میبرند و آب گرمشده را به منبع اصلی برمیگردانند.
آن کمتر از آبهای سرد است. آلودگی گرمایی آب ، اغلب به علت نیروگاههای برق میباشد که آب سرد را از رودخانهها یا دریاچه برای خنک کردن دستگاهها بکار میبرند و آب گرمشده را به منبع اصلی برمیگردانند. نقش مواد آلی در کاهش 
وجود مواد شیمیایی احیا کننده و بویژه مواد آلی در آب موجب مصرف و کاهش مقدار اکسیژن محلول میگردد. فاضلابها و پسابهای صنعتی و خانگی ، حاوی مقادیر زیادی مواد آلی هستند. تخلیه آنها در آبها ، بسرعت باعث آلودگی آب و کاهش  میشود. آبهای جاری در نهرها و رودخانههای کمعمق که هوادهی میشود، بطور
مداوم اکسیژندار میشوند. اما آبهای راکد یا آبی که نزدیک کف یک دریاچه
عمیق است، تقریباً عاری از اکسیژن است، زیرا با ماده آلی واکنش دارد و هیچ مکانیسمی برای تجدید آن وجود ندارد.
میشود. آبهای جاری در نهرها و رودخانههای کمعمق که هوادهی میشود، بطور
مداوم اکسیژندار میشوند. اما آبهای راکد یا آبی که نزدیک کف یک دریاچه
عمیق است، تقریباً عاری از اکسیژن است، زیرا با ماده آلی واکنش دارد و هیچ مکانیسمی برای تجدید آن وجود ندارد.از شاخصهای اساسی کیفیت آبها و پسابها تعیین مقادیر BOD (مقدار اکسیژن لازم جهت تجزیه مواد آلی موجود در آب) و COD ( اکسیژن لازم برای اکسیداسیون مواد قابل اکسید شدن موجود در آب) میباشد. تعیین
 یک روش کلیدی برای تعیین شاخص های مذکور به شمار میرود.
یک روش کلیدی برای تعیین شاخص های مذکور به شمار میرود. نقش اکسیژن محلول در خاصیت خورندگی آب
اکسیژن محلول در آب یکی از دلایل اصلی خاصیت خورندگی آب می باشد، آهن و اکسیژن در تماس با آب ، تشکیل قطبهای کاتد و آند را میدهند. آهن به عنوان آند عمل کرده ، به هیدروکسید فرو و سپس به هیدروکسید فریک و بعد از آن به اکسید آهن تبدیل میشود. با توجه به مشکلات متعددی که وجود اکسیژن در آبهای صنعتی (بویژه در آب جوشاورها) ایجاد میکند، حذف آن از آبهایی که استفاده صنعتی دارند، لازم است.روشهای حذف اکسیژن محلول از آب
حذف از آب را معمولاً تجزیه هوازدایی مینامند که به روش فیزیکی و شیمیایی انجام میگیرد. در روش فیزیکی از دستگاه خاصی استفاده میشود که با استفاده از جریان متضاد آب و بخار داغ ، اکسیژن را از آب خارج میکند. پس از هوازدایی به روش فیزیکی برای تکمیل عملیات از روش شیمیایی استفاده میشود که به سه صورت انجام میگیرد:
از آب را معمولاً تجزیه هوازدایی مینامند که به روش فیزیکی و شیمیایی انجام میگیرد. در روش فیزیکی از دستگاه خاصی استفاده میشود که با استفاده از جریان متضاد آب و بخار داغ ، اکسیژن را از آب خارج میکند. پس از هوازدایی به روش فیزیکی برای تکمیل عملیات از روش شیمیایی استفاده میشود که به سه صورت انجام میگیرد:- اضافه کردن سولفیت سدیم (با جذب اکسیژن به سولفات سدیم تبدیل میگردد)
- اضافه کردن هیدرازین
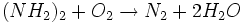
- استفاده از گاز
 در محیط قلیایی
در محیط قلیایی

روشهای اندازه گیری 
روش فیزیکی
امروزه برای اندازه گیری در محل نمونه برداری از دستگاههای کوچک سیار که مجهز به الکترود غشایی است، استفاده میشود. الکترود غشایی بر اساس سرعت نفوذ مولکولهای اکسیژن از یک غشا ساخته شده است. این روش فیزیکی بطور ساده و سریع انجام میگیرد.
در محل نمونه برداری از دستگاههای کوچک سیار که مجهز به الکترود غشایی است، استفاده میشود. الکترود غشایی بر اساس سرعت نفوذ مولکولهای اکسیژن از یک غشا ساخته شده است. این روش فیزیکی بطور ساده و سریع انجام میگیرد. روش شیمیایی وینکلر یا یدومتری
یدومتری دقیقترین و قابل اعتمادترین روش اندازه گیری  میباشد. این روش یک روش تیتراسیونی است که بر اساس خواص اکسیدکنندگی اکسیژن محلول انجام میگیرد. با افزایش
میباشد. این روش یک روش تیتراسیونی است که بر اساس خواص اکسیدکنندگی اکسیژن محلول انجام میگیرد. با افزایش  به محلول قلیایی شده آب ، هیدروکسید منگنز با اکسیژن محلول آب ترکیب شده ، ایجاد
به محلول قلیایی شده آب ، هیدروکسید منگنز با اکسیژن محلول آب ترکیب شده ، ایجاد  میکند. با مصرف تمام اکسیژن موجود ، محلول اسیدی میشود. با افزودن یدور ،
میکند. با مصرف تمام اکسیژن موجود ، محلول اسیدی میشود. با افزودن یدور ،  در محیط اسیدی با یون یدور ، وارد واکنش شده ، ید آزاد میکند. مقدار ید آزاد شده توسط محلول تیوسولفات تعیین میشود و از روی مقدار تیوسولفات مصرفی ، مقدار اکسیژن موجود در آب محاسبه میشود.
در محیط اسیدی با یون یدور ، وارد واکنش شده ، ید آزاد میکند. مقدار ید آزاد شده توسط محلول تیوسولفات تعیین میشود و از روی مقدار تیوسولفات مصرفی ، مقدار اکسیژن موجود در آب محاسبه میشود.
اساس روش اندازهگیری:
معمولیترین
روش تعیین اکسیژن محلول بر اساس آزاد کردن ید توسط اکسیژن محلول میباشد.
ید آزاد شده عموماً توسط یک محلول احیاءکننده مانند تیوسولفات سدیم
اندازهگیری میشود. چسب نشاسته خاتمه عمل را نشان میدهد. نشاسته ید آزاد
شده را جذب نموده و رنگ آبی ایجاد میکند و هنگامیکه تمامی ید احیاء گردید
محلول بیرنگ میشود.
روش و نیکلر یا یدومتری روش استانداردی برای تعیین
اکسیژن محلول میباشد. این روش بر اساس اکسیداسیون Mn2+ به ظرفیت بالاتر
(Mn4+) در محیط قلیائی توسط اکسیژن میباشد. منگنز با ظرفیت چهار یون ید را
در محیط اسیدی به ید آزاد اکسیده میکند و مقدار ید آزاد شده که برابر با
اکسیژن محلول میباشد توسط تیتزاسیون با تیوسولفات استاندارد اندازهگیری
میشود.
در این روش وجود بعضی از مواد مانند نیتویتها و آهن سه ظرفیتی
قابلیت اکسیدکنندگی I- را به I2 دارند. و نتیجه آزمایش را زیاد نشان
میدهد. و بر عکس مواد احیاء کننده مانند S2-, So32-, Fe2+ ید را احیاء
کرده و به I- تبدیل میکنند و نتیجه آزمایش را کمتر از حد واقعی نشان
میدهد. بنابراین روش تصحیح نشده چنانکه اکسیژن در محیط وجود نداشته باشد
با افزایش سولفات منگنز و معرف یدور قلیائی (NaOH, KI) رسوب سفید رنگ
2Mn(OH) تشکیل میگردد.
Mn2+ + 2OH- Mn(OH)2
ادامه مطلب ...